Monitoraggio microplastica - progetto pilota (2019)
In luglio 2019 il Laboratorio biologico ha avviato per la prima volta un campionamento per rilevare la presenza di microplastiche nei sedimenti ripariali del fiume Adige, il principale corso d’acqua della provincia di Bolzano. Si è trattato di un campionamento esplorativo, allo scopo di mettere a punto la metodica di indagine e la strumentazione necessaria.
Il sito di campionamento si trova a nord dell’abitato di Laghetti, precisamente sulla sponda orografica sinistra del fiume Adige. L’area campionata si localizza lungo la drift line, il settore della riva frequentemente bagnato dalle acque del fiume, ed ha una dimensione di 1020 m2 (Galleria fotografica, Foto 1 e 2).
Il campionamento dei sedimenti ripariali è stato eseguito seguendo le linee guida adottate per le spiagge marine (1). Innanzitutto, è stato eseguito il censimento delle macroplastiche presenti nell’area del campionamento, individuando tutti gli oggetti di plastica presenti, aventi una dimensione superiore ai 5 mm. Una quota di tali oggetti/rifiuti è stata prelevata e portata in laboratorio allo scopo di confrontarli successivamente con i frammenti di microplastica rinvenuti nel sedimento. Successivamente si è proceduto con il campionamento del sedimento vero e proprio. I campioni devono essere prelevati nello strato superficiale di 5 cm, con un minimo di 3 repliche casuali separate da almeno 5 m, per ognuna delle due categorie di microplastiche: Small-Microplastic (SMP: < 1 mm) e Large-Microplastics (LMP: 1 - 5 mm) (2). Tutti i campioni prelevati sono stati conservati in contenitori di vetro o metallo.
Annotazioni:
(1) Le metodiche maggiormente utilizzate negli ultimi anni sono quelle indicate da Georg Hanke in “Guidance on Monitoring of Marine Litter in European Seas”, pubblicato nel 2013 da "EU Technical Subgroup on Marine Litter (TSG-ML)", e quelle suggerite da Löder e Gerdts (2015).
(2) Per le Large-Microplastics è stato prelevato con un cucchiaio di metallo lo strato di 5 cm di sedimento superficiale presente in un quadrato di 50x50 cm. Per ciascuna delle 3 repliche sono stati raccolti 12.500 cm3. Anche le Small-Microplastic sono state prelevate con un cucchiaio di metallo, campionando per ciascuna delle 5 repliche 250 cm3 di sedimento.
I campioni di sedimento sono stati fatti essiccare a 60°C per 48 ore in contenitori di alluminio. Successivamente, i campioni per le Small-Microplastic sono stati filtrati attraverso un setaccio di 1 mm, mentre quelli per le Large-Microplastics attraverso un setaccio da 5 mm in uno da 1 mm, pesati e conservati in contenitori di vetro. L’estrazione delle microplastiche dal campione di sedimento può essere suddivisa in quattro fasi: pre-selezione visiva, separazione in base alla densità, filtrazione e purificazione (1).
Annotazione:
(1) La pre-selezione visiva di tutti i campioni di sedimento (sorting) è stata effettuata allo stereomicroscopio e i frammenti visibili di microplastica sono stati prelevati con una pinzetta, suddivisi e conteggiati in base alla forma (sfera, filamento, frammento, foglio) e conservati per eventuali ulteriori analisi. La successiva separazione densimetrica è stata eseguita sfruttando la minore densità della plastica rispetto ai granelli di sabbia. Il sedimento essiccato è stato mescolato con una soluzione salina satura, come NaCl ad una concentrazione pari a 1,5 g/cm3. Dopo avere aggiunto 200 ml di NaCl a 50 ml di sedimento in un cilindro, e si è agitato a mano per 2 minuti, si è lasciato quindi sedimentare per altri 2 minuti. Tale procedimento è stato ripetuto per 3 volte. Essendo la plastica meno densa galleggia in superficie e viene quindi separata prelevando il surnatante e filtrandolo attraverso un filtro in fibra di vetro da 10 µm. I filtri sono stati successivamente conservati in capsule Petri. I filtri devono essere ulteriormente purificati, rimuovendo eventuali residui organici che potrebbero inficiare la successiva osservazione al microscopio e le eventuali analisi spettroscopiche come la “Raman spectroscopy”. A questo scopo ai filtri essiccati sono stati aggiunti 2 ml di H2O2 (perossido di idrogeno) al 30% per 30 minuti, quindi sono stati lavati con 4 ml di acqua ultrapura e messi ad essiccare.
In seguito alla purificazione con perossido di idrogeno tutti i filtri sono stati osservati al microscopio, secondo i seguenti criteri (1):
-
Non devono essere visibili strutture di origine organica nelle fibre o particelle di plastica
-
Le fibre devono essere di uguale spessore e le particelle di uguale colore
-
Particelle bianche o trasparenti devono essere osservate ad elevato ingrandimento e con l’aiuto di un microscopio a fluorescenza per escluderne l’origine biologica
-
Le caratteristiche generalmente usate per separare e classificare le microplastiche sono la sorgente, il tipo, la forma, lo stadio di degradazione e il colore.
Annotazione:
(1) Per l’identificazione delle microplastiche allo stereomicroscopio è stata seguita la metodica standardizzata suggerita da Nòren nel 2007.
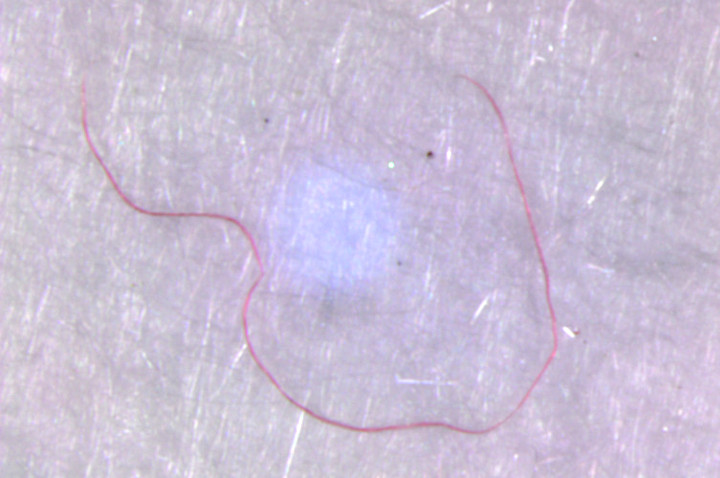
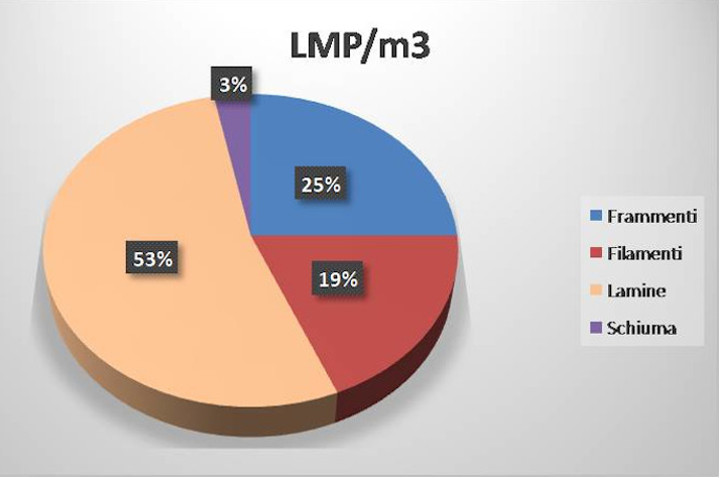
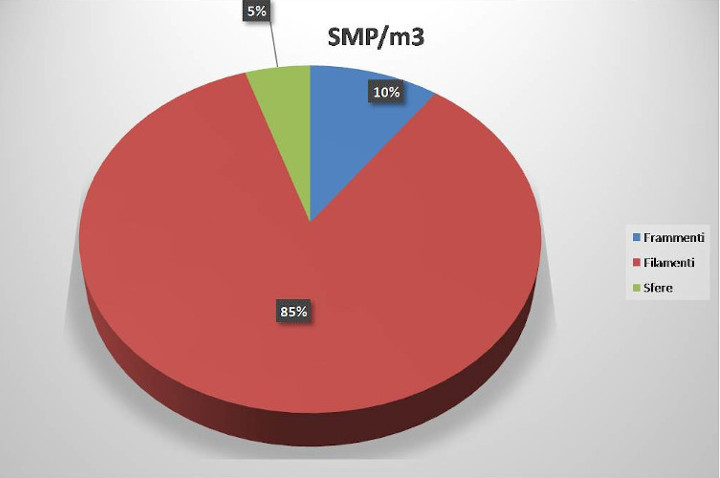
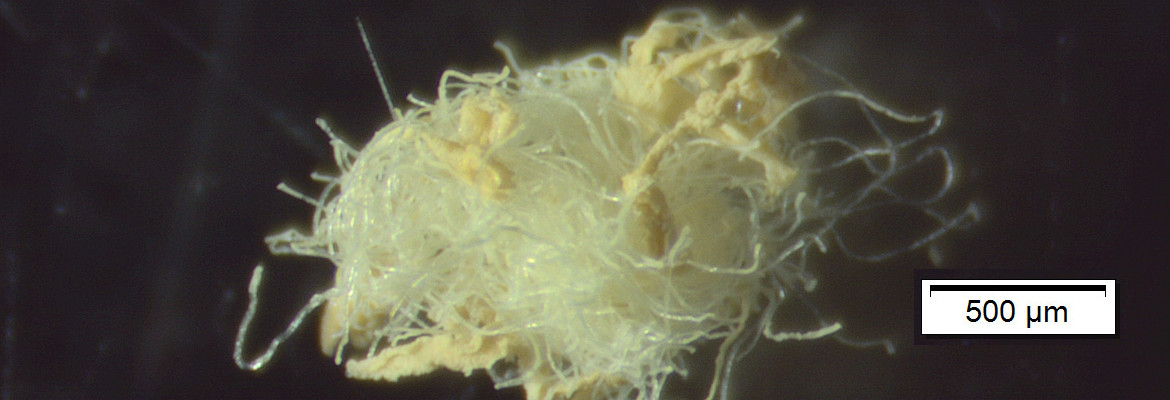
La prima parte del campionamento ha riguardato il censimento delle macroplastiche presenti nell’area di ricerca e ha permesso di individuare la presenza di un numero piuttosto elevato di oggetti/rifiuti, prevalentemente in plastica, con una densità finale di 0,1 oggetti per m2 (vedi Galleria fotografica, foto 3). Per quanto riguarda le microplastiche (MP), è stata riscontrata una concentrazione complessiva di 842,67 microplastiche per m2. Le microplastiche rinvenute erano di diversa forma e colore (vedi galleria fotografica, foto 4 e 5), relative sia alle large microplastic (LMP) osservate dopo la pre-selezione dal sedimento, che alle small microplastic (SMP) sui filtri in fibra di vetro. Se si analizza la densità delle singole tipologie di microplastiche presenti nei campioni di small microplastic (grafico 1) si nota come i filamenti rappresentino l’85% del totale, mentre nei campioni di large microplastic (grafico 2) predominano i frammenti a forma di lamina, con una concentrazione del 53%.
I risultati da noi rinvenuti sono confrontabili con quelli trovati nell’ambito di altre ricerche analoghe, tra cui quelle svolte sul lago di Garda (Imhof et al., 2013) con 1108 MP/m2. Si tratta di valori che rientrano nella media, ma che sono un chiaro esempio di come anche nei nostri corpi idrici siano presenti microplastiche. La prevalenza di filamenti, come rilevato anche da altri studi condotti su laghi e fiumi, è probabilmente causata dal lavaggio dei tessuti sintetici, non trattenuti dagli impianti di depurazione. Le microplastiche si trovano ormai ovunque.
Riferimenti normativi: consulta la pagina sulla legislazione
Contatto: Laboratorio biologico